
CAR-T引爆腫瘤治療戰火、台廠拚突圍
科技產業資訊室 (iKnow) - May 發表於 2017年10月30日
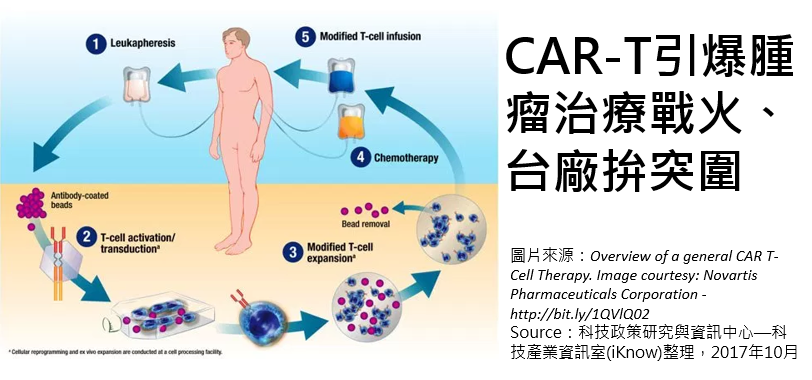
針對癌症末期患者或無藥可醫的患者做細胞治療,不需長期的治療時間,同時產生的副作用較小,腫瘤治療CAR-T療法屢創新里程碑,近幾個月來美國食品藥物管理局(FDA)接連批准諾華(Novartis)、吉利德(Gilead)所併購的凱特(Kite)旗下CAR-T療法上市,而台廠是否能在這場CAR-T療法的戰役中突圍,也備受矚目。
CAR-T療法全名「嵌合抗原受體重組T細胞」(chimeric antigen receptor T-cell),主要製程是指從病人身上分離出免疫T細胞,用基因工程技術,將T細胞加上「導航」、大量培養,並回輸患者體內,而這樣的CAR-T細胞能夠辨識並進一步殺死癌變細胞,達到治療的效果。當前的CAR-T療法多針對血癌領域,國際大廠如諾華、Juno、Kite等,多投入血癌治療,例如諾華Kymriah為例,療法鎖定的就是「急性淋巴性白血病」(ALL)。
根據EvaluatePharma預測,目前全球抗腫瘤市場規模約1,000億美元,但在免疫治療興起下,初估2020年全球腫瘤市場規模可望達到1,500億美元。其中,以CAR-T為代表的細胞免疫療法,預估在2020年可達到150億美元規模。
美國CAR-T療法引爆腫瘤治療戰火
諾華CAR-T療法產品Kymriah首次FDA批准上市
CAR-T療法在今年(2017)7月才正式引爆戰火,7月間美國FDA腫瘤藥物專家諮詢委員會以「十比零」投票結果,一致推薦諾華開發的CAR-T療法產品Kymriah上市,邁入下一新里程碑。諾華於2017年8月30日宣布,其CAR-T治療白血病產品Kymriah也於美國FDA首次批准上市。並成功治療病童。也因此,被譽為是繼免疫檢查點抑制劑(PD1/PDL1)之後,另一個革命性的腫瘤治療法。然而,療程價格$47.5萬美金。
Gilead旗下Kite開發的CAR-T產品Yescarta
美國藥廠吉利德(Gilead )於2017年8月28日宣布,不惜巨資以119億美元現金收購同樣發展CAR-T療法的美國生物製藥公司Kite。之後,10月18日FDA也批准Gilead旗下子公司Kite開發的CAR-T產品Yescarta上市。然而,療程價格$37.3萬美金。
Yescarta的適應症是「瀰漫性大B細胞淋巴瘤」(Diffuse large B cell lymphoma, DLBCL)),所針對的患者是經其他療法無明顯改善的成年病人,這是今年全球第二個獲准上市的CAR-T方法,也是全球第一個用於「非霍奇金氏淋巴瘤」 (NHL) 的細胞療法。
我國「人體試驗管理辦法」
台灣針對細胞治療,雖於2014年及2015年,衛生福利部就分別公告了《人類細胞治療產品臨床試驗申請作業與審查基準》、《人類細胞治療產品查驗登記審查基準》及《人類細胞治療產品捐贈者合適性判定基準》。且去年(2016)衛生福利部公告新增「人體試驗管理辦法」,讓目前進行免疫細胞療法研究的醫師可額外替患者做細胞治療,針對無藥可醫的癌症末期患者,即俗稱的恩慈條款。目前國內約有7~8個免疫細胞療法新藥實驗中。今年7月又公告了《細胞及基因治療產品管理法草案》,且明定細胞治療產品臨床試驗申請需有試驗送件前諮詢。然而對於幹細胞生產卻仍無一通用標準,目前台灣所有幹細胞相關產品都仍在臨床試驗階段,其試驗數已占細胞治療總數的34%。
台廠拚突圍
近日,台廠有多家公司切入CAR-T療法市場,包括:育世博、震泰生醫、源一、鑫品等。且已有多家台廠瞄準中國大陸CAR-T療法市場,並已經布局多時,與大陸地區三甲型醫院合作、針對淋巴瘤適應症進行研究型試驗。如今,而究竟誰能搶得先機,值得進一步觀察。
源一公司
其中,源一公司將先在兩岸啟動臨床試驗,有機會成為首家在台申請CAR-T臨床(IND)的生技公司。源一技術來自德國科隆大學(UKK),在臨床前試驗取得不錯的數據,選擇從實體腫瘤治療領域切入,鎖定腸胃腫瘤領域,鎖定CEA癌胚抗原,開發專屬的CAR-T療法,第一個適應症,有可能選定胰臟癌、大腸癌等。
過去,大陸西南大學也曾以該技術做過學術型的人體臨床研究,在人體安全性方面應無疑慮,未來源一也將繼續在兩岸進行有關研究,最快明年(2018)申請兩岸人體臨床試驗。下一步,源一將先在台灣進行學術型臨床研究,目前正在與高醫、榮總洽談合作,而大陸方面則將選擇在上海的三甲型醫院進行,最快明年上半年正式申請人體臨床。
鑫品生醫
鑫品生醫,CAR-T免疫細胞療法已完成的體外與動物實驗,於2016年11月宣佈與台大醫院及山東省聊城市人民醫院完成簽約,將在兩岸同步開展血癌CAR-T免疫細胞療法臨床試驗。鑫品表示,除在台大醫院建立CAR-T細胞體外培養平台,作為未來開發治療血癌、淋巴癌等藥物之運用。
大陸山東省聊城市人民醫院則啟動第一、二期人體臨床試驗,以CAR-T 技術治療再復發或無任何藥物可醫治的血癌與淋巴癌末期患者30名進行試驗。由於鑫品CAR-T為一次性療程的特色,前期數據將可盡快取得。
育世博、震泰結盟攻免疫細胞療法
育世博於2016年底,由楊育民(前羅氏製藥全球技術營運總裁)與旅美創業家蕭世嘉所創立,專攻於免疫細胞抗體鍵結技術及新藥開發。首個開發項目是用於治療卵巢癌,預計2018年以前能完成人體臨床前的所有毒理和劑量遞增試驗,並申請在台灣和美國進行人體臨床。育世博已被鴻海集團旗下永齡健康基金會H.Spectrum加速器相中,進行育成孵化。
震泰由李冬陽所創辦,曾任職於中天集團旗下的泉盛和協和新藥,他曾跟隨享譽國際的血管新生之父,已故美國哈佛大學教授Dr. Judah Folkman進行藥物開發,參與開發年銷售總額超過150億美元的3項血管新生抑制劑藥物。
有別於諾華藥廠是以病毒作為載體的方式,震泰以最新一代無病毒載體技術,未來將大幅縮短治療流程並降低治療費用,而育世博則利用抗體結合細胞治療的創新概念,改善現有細胞免疫治療之不足,預期兩家的結盟,產生的資源互補效應,將可加速CAR-T的開發。目前,震泰與育世博分別被美國波士頓孵化器及鴻海旗下永齡健康基金會H.Spectrum加速器相中,進行育成孵化。
結語
由於,CAR-T療法是一種高度客製化的藥物生產模式,因此藥價高昂,每個病人的治療費約50萬美元,但未來,在更多新創生技業者及資金投入之下,應該可以漸進式降低治療費。
就CAR-T而言,目前主要問題是適應症還太少,且療程費用太高昂。所以,台灣醫藥業者若能避開歐美大廠已投入的適應症,從華人或亞洲病患的常見病症切入,未來市場空間也很大。(1296字;圖1)
[註解]
相較於傳統化療或標靶治療之不同,免疫療法是透過「活化宿主免疫系統」來達到抗癌效果,可分成「免疫檢查點療法」及「細胞免疫療法(CAR-T)」兩種。「免疫檢查點療法」,能解除腫瘤對免疫系統的抑制作用,促使CD8-T細胞活化,進而抑制並破壞腫瘤細胞,這類型藥物近年陸續被美國FDA核准上市,從2014年第一個針對免疫檢查點CTLA-4的藥物Yervoy上市後,至2017年已有六個同類產品問世,包括Yervoy、keytruda、Opdivo、Tecentriq、Imfinizi及Bavencio。「細胞免疫療法CAR-T」從患者身上分離T細胞,利用基因工程技術進行改造,使T細胞能夠辨認患者腫瘤細胞的抗原並攻擊消滅腫瘤。2017年8月及10月,美國FDA先後核准了諾華(Novartis)的Kymriah用以治療急性淋巴細胞白血病以及吉利德(Gilead)的Yescarta用以治療瀰漫型大B細胞淋巴瘤。
參考資料:
Novartis receives first ever FDA approval for a CAR-T cell therapy, Kymriah(TM) (CTL019), for children and young adults with B-cell ALL that is refractory or has relapsed at least twice. Novartis, 2017/8/30.
The FDA Approves a Second CAR-T Therapy, Cheaper than Novartis’. Labiotech, 2017/10/19.
--------------------------------------------------------------------------------------------------------------------------------------------
【聲明】
1.科技產業資訊室刊載此文不代表同意其說法或描述,僅為提供更多訊息,也不構成任何投資建議。
2.著作權所有,非經本網站書面授權同意不得將本文以任何形式修改、複製、儲存、傳播或轉載,本中心保留一切法律追訴權利。
|