
新冠病毒(COVID-19)疫苗開發公共研發投資組合評估:以CEPI為例
黃勁勳、劉玳縈、張錦俊 發表於 2020年3月3日
一、緒論
世界衛生組織針對中國武漢所爆發新冠病毒(COVID-19)疫情,將其列為緊急公衛事件,並於2月3日公布「策略防備與因應規劃」報告書中指出,國際社會應就研究與創新的優先領域及解決問題的最有效方法達成共識,治療疾病、降低社會大眾的恐慌與預防下一波流行(WHO, 2020a),因而需要進行疫苗和老藥新用的開發,例如,已上市或有臨床試驗數據用於其他疾病如愛滋病或中東呼吸症候群(MERS, middle-east respiratory syndrome)的藥物,用以治療新冠病毒患者。
本文針對目前針對疫苗開發的主要技術途徑,區分為mRNA (messenger RNA, 傳訊RNA)疫苗、DNA疫苗與傳統疫苗等途徑,並簡介技術原理,並比較疫苗開發的不同技術途徑之成本效益及開發上市所需時程,並據以評估流行病整備創新聯盟(Coalition for Epidemic Preparedness Innovations,CEPI)之補助疫苗開發計畫的研發投資策略,並透過實例說明CEPI之研發投資組合之不足之處及無法處理風險,說明為何難以吸引大藥廠投入疫苗開發。
二、人體免疫系統之運作原理
(一) 先天免疫與後天免疫之區分
在進行疫苗特性簡介前,首先介紹人體的免疫系統主要分為先天免疫(natural immunity)以及後天免疫(acquired immunity)。先天免疫指的是生理屏障(如,皮膚、黏膜等構造阻隔外來物質的侵入)、白血球的吞噬作用或是發炎反應等;而後天免疫則是需要接觸過抗原之後才產生的專一性的抵抗能力,參與的細胞主要是T細胞(T-lymphocyte)以及B細胞(B-lymphocyte)。後天免疫又分為主動免疫(active immunity)和被動免疫(passive immunity)。主動免疫是指個體的免疫系統受到外來抗原(如,細菌、病毒或是接種疫苗)的刺激自行產生的免疫力;被動免疫是指個體直接接受曾受感染的動物或是人類的血清(如,母體IgG或是蛇毒血清)。一般而言,主動免疫的效果比較好,而且可以維持數年甚至是終身免疫。隨著醫學的進展與發達,接種疫苗成了人類增強主動免疫的一項利器。
(二)主動免疫與被動免疫之原理:T細胞與B細胞
人體的免疫系統內有許多免疫細胞,當外來物入侵人體的時候,身體裡的T細胞(T-lymphocyte)與自然殺手細胞(natural killer cell)會直接與抗原(antigen,如病毒或是細菌等外來入侵者)結合,而B細胞(B-lymphocyte)能製造並釋放抗體(antibody),讓抗體與抗原結合,以達到中和毒性或是消滅外來物質的目的。當個體再遇到相同抗原侵襲時,免疫系統便可發揮其記憶特性,產生強大且快速的免疫反應以消滅抗原,而接種疫苗就是為了能讓免疫系統擁有這項能力。目前疫苗主要有傳統疫苗(蛋白質疫苗)、以及核酸疫苗(DNA疫苗及mRNA疫苗),以下將分項討論其特性、製備方式以及在臨床應用上所面臨的挑戰。
(三)疫苗開發途徑評估:傳統疫苗、DNA疫苗與mRNA疫苗
1. 傳統疫苗
主要是利用失去活性或是減少毒性的病毒蛋白質所帶有的外源性抗原(Exogenous antigens)注入人體,使得人體的後天免疫系統對其產生抗體進而達到免疫的效果。
目標病原體/抗原在特定的細胞培養和/或發酵生產中生長,然後再進行萃取,殺死,分離和純化。
1.製備方式漫長、複雜且昂貴。
2.常依經驗證明其療效,療效機制不明。
3.不同的疫苗種類需要特定的生產方式、設備以及操作人員。這些資本投資必須在疫苗批准之前數年進行,而風險則是疫苗最終可能會失敗並浪費資本投資。
4.大多疫苗都需要有佐劑(增強疫苗效力的化合物)進行輔助,而搭配佐劑之開發需評估及效益與風險,在安全性與有效性之間取得平衡。
2. DNA疫苗
將抗原的DNA片段植入質體(plasmid),經由質體進入人體細胞產生內源性抗原(endogenous antigens),透過內源性抗原引發免疫的作用,也就是將病毒蛋白基因轉移到質體,再將將質體注射到病人皮膚或肌肉細胞(需要特殊傳輸方式),讓病人細胞產生病毒蛋白,模仿病毒感染並誘導強烈的免疫反應(Burke, 2017)(圖1)。由於是透過質體做為載體進入人體細胞,可搭載數種不同抗原DNA片段達到一劑抵抗抗原或是疾病的效果(圖2)。
圖1 DNA疫苗經由質體進入細胞誘導免疫反應
資料來源:Burke, 2017。
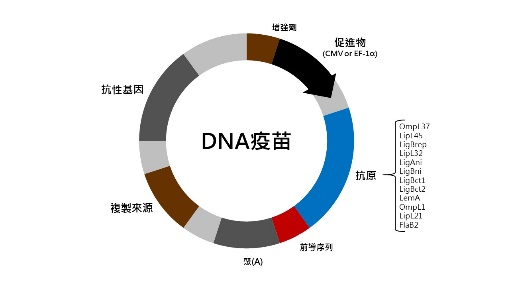
圖2 DNA疫苗中使用了不同的抗原
資料來源:Silveira et al., 2017。
主要是利用基因工程的方式將一個或是數個抗原的DNA片段放入細菌質體內(如,大腸桿菌或酵母菌),藉由菌體大量製造,純化之後得到疫苗。由於此技術是一項平台,所以無論抗原的編碼基因為何都可以透過相同的技術製造。
1.需要大劑量方能有效:必須穿過細胞膜與細胞核膜才能產生作用,需要大劑量才能有效果。
2.需要特殊的傳輸方式:由於DNA疫苗需要進入細胞核才能產生作用,例如,利用顯微注射(microinjection)、基因槍(gene gun)、超音波(ultrasonic)或是電穿孔(electroporation)等方式,促使細胞膜及核膜打開讓DNA疫苗順利進入細胞核內。
3.造成基因突變之風險:質體DNA有可能嵌入到人體細胞的基因組產生基因突變的風險變高,進而產生致癌性的安全疑慮。
4.高濃度方能產生效果:需要比較高的濃度產生免疫效果。
3. mRNA疫苗
相較於DNA疫苗,mRNA疫苗不需要進入人體體細胞的細胞核就能產生內源性抗原,mRNA疫苗也沒有嵌入人體基因體的疑慮。
利用抗原的DNA片段作為模板(template),可透過人工方式大量製造得到。
1.安定性不佳及保存不易。
2.容易引發強烈免疫反應,仍需要累積臨床試驗來證明其安全性。
(四)不同疫苗技術途徑之開發時程比較
一般而言,傳統疫苗在開發的時程為10-15年,而核酸疫苗(DNA及RNA疫苗)只要4-7年的開發時程(圖3)。製造方面,傳統疫苗需要在雞蛋或是動物體身上大量生產之後經過純化減毒等一系列繁複的工序之後才能得到,而且也需要根據不同的感染源訂製不同的生產過程。而核酸疫苗的製程相對精簡且標準化,不同的抗原可以經由相同的製程產生。
在安全性方面,由於傳統疫苗使用的歷史悠久,使用的人數多,所以在安全性以及副作用方面的研究紀錄都比核酸疫苗來的完整,核酸疫苗仍需要大量的臨床試驗來證明其安全性,尤其像是DNA在基因突變或是致癌性上的疑慮。而隨著人工智慧在生物醫學的進展,核酸疫苗的發展可以利用基因庫的大數據,先分析出細菌或是病毒等感染源的基因體序列,預測出那些表面蛋白質會引起免疫反應,進而開發出相對應的核酸疫苗(Rachlin E. & Watson M. 2017; Zhang C. et al., 2019)。
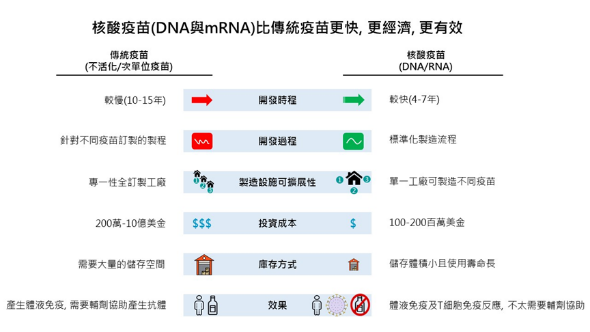
圖3 核酸疫苗(DNA與mRNA)與傳統疫苗的比較
資料來源: Rachlin & Watson 2017。
四、CEPI對COVID-19之疫苗開發之公共補助投資組合分析
(一)CEPI之COVID-19公共補助投資組合
目前針對COVID-19疫苗開發之公共補助主要係由流行病防備創新聯盟(CEPI)所資助的四大計畫,CEPI是政府、企業、學術界、慈善機構、政府間機構(例如世界衛生組織)和公民社會之間的新聯盟,CEPI之成立目的在於填補WHO所缺少的促進疫苗開發的供給面缺口,旨在補助和協調新疫苗的開發,並建立公私合夥研發合作關係,以預防和控制傳染病的流行。
疫苗開發的計畫補助也涉及計畫篩選與投資組合,CEPI資助的四大COVID-19疫苗開發計畫,爲了快速找出候選物進入臨床試驗及提高成功率,因此需在補助時進行疫苗開發技術途徑上多元投資組合,CEPI所選擇的投資組合如下:
- Moderna Therapeutics的mRNA疫苗:Moderna 公司將與美國衛生研究院(National Institutes of Health, NIH)共同合作,由屬於NIH的美國國家過敏和傳染病研究所的疫苗研究中心執行設計疫苗合作、申請新藥臨床試驗(investigational new drug)與臨床第一期的研究,Moderna將生產針對COVID-19的mRNA疫苗,研究團隊選擇了一種主要的病毒蛋白來接種疫苗,還選擇了六種備用蛋白。
- Inovio Pharmaceuticals的DNA疫苗:CEPI提供Inovio Pharmaceuticals 900萬美元進行開發COVID19病毒疫苗的臨床前到臨床第一期資金,用以試驗疫苗INO-4800,此DNA疫苗與新冠狀病毒爆發的菌株吻合。有七個月讓疫苗從平台探索階段進入人體試驗的經驗,以目前技術應可以縮短疫苗開發時程因應目前COVID19病毒的挑戰(Inovio Pharmaceuticals Inc., 2020)。
- 澳洲昆士蘭大學的分子鉗疫苗(DNA與mRNA疫苗之通用技術):利用分子鉗(molecular clam)即一段多肽鏈來穩定蛋白質的型態增加疫苗的效果,因為使用分子鉗穩定膜融合蛋白(viral fusion proteins)的結構,可以使免疫系統更容易識別為抗原,經由純化合成抗原之後便可以快速製備成疫苗。研究團隊目標是未來六個月內開發出一種疫苗,以幫助遏制這次疫情(UQ News, 2020)。
- 德國CureVac公司的mRNA疫苗之快速反應疫苗平台:CEPI補助高達830萬美元的初始資金,用於加速疫苗的開發、生產和臨床試驗。預期在幾個月內將病原的基因序列帶入候選疫苗進行臨床試驗(Global Biodefense, 2020)。
CEPI希望在16週找出疫苗候選物進入臨床試驗,因此,在1月底前所資助的四大計畫目的是快速篩選出候選物,加上合作公司、單位與夥伴沒有任何一張疫苗的藥證,更沒有大量生產製造設施,因此,需要補助投入疫苗開發(申請截止日期2020/2/14)這次補助重點為製造與開發,尤其需要具備大量製造能力的公司加入,以補足先前投資組合在製造(幾百萬支疫苗)的不足。
(二)CEPI之COVID-19公共補助投資策略之特性
綜觀CEPI前述之主要補助疫苗開發計畫之研發投資組合,有以下特點:
- 聚焦於縮短開發時程:CEPI主要補助DNA與mRNA之疫苗開發途徑,這兩類技術開發途徑的開發時程較短。
- 聚焦於臨床前階段與臨床一期階段:此一階段具有較嚴重的私人企業低度投資(underinvestment)問題,從市場失靈的角度來看,需要公共研發補助之介入。
- 聚焦於平台技術(通用技術) :CEPI之投資組合主要在於開發快速反應疫苗平台、分子鉗疫苗(DNA與mRNA疫苗之通用技術),此一投資策略係為加速技術商業化時程,Tassey (2005)指出,技術開發可區分為基礎技術(infratechnology)(檢驗、材料等技術)、通用技術(平台技術)與專有技術(針對企業特定商品之技術),其中,通用技術的開發風險最高,且因為不像專有技術一樣研發成果可以被投資企業所專用,因此廠商的投資誘因很低,並產生嚴重的低度投資問題,因此,CEPI的公共補助疫苗開發之投資組合聚焦於平台技術,是很合理的研發投資策略,可解決低度投資問題,並有效降低平台技術開發風險。
(三)CEPI研發投資策略不足之處
1.忽略阻礙大型藥廠投資疫苗開發之成本與需求考量
許多大藥廠不太願加入新疫苗開發,在成本與需求面向的主要原因包括:
- 大量製造疫苗的成本
- 研發所耗費的時間與成本
- 病毒大流行是否會如SARS一般不再重複出現,而造成開發出世界不需要的疫苗、投入成本無法回收。
許多大藥廠因在過去公衛緊急事件中競相開發疫苗,但最後所開發疫苗並無持續市場需求(Branswell, 2020),這些慘痛經驗使得大藥廠對於是否投入COVID-19的疫苗開發心存觀望,2月初僅葛蘭素史克(GlaxoSmithKline, GSK)與CEPI合作,讓GSK的佐劑平台技術用於開發新冠病毒疫苗,在能力範圍內提供協助與合作,不再是整個投入疫苗研究與開發。這表示,CEPI單靠通用技術及臨床前階段的研發投資,仍不足以吸引大藥廠投入COVID-19疫苗開發。GSK雖然希望對公衛緊急事件有所幫助但因疫苗開發風險,而無法再像過去一樣投入(Branswell, 2018),僅以佐劑(proprietary adjuvant),協助CEPI資助的其他單位可使用GSK佐劑平台技術,GSK佐劑只需少量抗原便能生產大量疫苗。
以大藥廠默沙東(Merck Sharp & Dohme Corp., MSD)為例,2019年底美國FDA批准,用於18歲以上的成人伊波拉病毒(ebolavirus)疫苗Ervebo,此疫苗可以對抗六種伊波拉病毒的其中一種Zaire,無法對抗與防範其他種類伊波拉病毒(吳培安,2019)。這是目前唯一完成臨床第三期試驗而獲批准的伊波拉疫苗,但由於經過長時間的開發成本,加上俄羅斯和中國開發疫苗核准為緊急使用疫苗(這兩國開發和監管與西方國家的差異,使得其批准速度更快),縮減使用MSD所研發伊波拉疫苗的市場(Branswell, 2017),使得儘管獲得批准但MSD表示不會再開發跟伊波拉病毒與Marburg病毒相關疫苗(Branswell, 2018)。這表示,除了疫苗的長期需求的不穩定性除了源自於是否成為反覆出現的流行病之外,也可能受到各國緊急使用疫苗的管制政策介入之影響,而使廠商投入開發面臨需求及獲利的高度風險。
隨著COVID-19病毒迅速擴散,與SARS相比具有較高傳染力及較低致死率,有可能轉變為較嚴重的流感而持續流行而產生長期需求,這提升藥廠開發疫苗的意願,例如,賽諾菲(Sanofi) 2月18日宣布與美國衛生及公共服務部旗下美國生物醫學高級研究與發展管理局(Biomedical Advanced Research and Development Authority,BARDA) 合作開發COVID-19疫苗(Pagliarulo, 2020)。
2. 忽略科技風險對大企業研發投資意願之影響
為何大藥廠仍在觀望是否加入協助疫苗開發,科技風險為其主要考量之一,
以賽諾菲為例,該公司所投入研發的治療登革熱之Dengvaxia疫苗,因為有些菲律賓兒童注射後出現死亡案例,由於該疫苗之開發設計仿登革熱感染,實際注射發現未經感染登革熱者進行疫苗接種後,日後感染成為重症的機率,比未接種疫苗者更高,此一非預期結果與科技風險嚴重破壞公司商譽(Branswell, 2018)。
檢視CEPI的研發投資組合,因考量縮短時程,集中於補助DNA與mRNA之疫苗開發途徑,而這些疫苗開發途徑,具有基因突變之風險,一旦廠商開發成功後,出現如Dengvaxia疫苗一樣的副作用,將造成廠商的重大損失。
因此,CEPI除了補助對於疫苗產品及製造之研究開發之外,也應該補助品質研究(quality research),協助廠商控制品質問題即可能產生副作用,以協助企業降低科技風險所帶來的財務及商譽損失。
3. 疫苗公共研發補助之穩定性問題
由於美國生物醫學高級研究與發展管理局(BARDA)決定不繼續資助臨床試驗,因而促使賽諾菲開發茲卡(Zika)病毒疫苗計畫到晚期臨床試驗階段喊停(吳培安, 2020)。
因應公衛緊急事件之疫苗開發,對社會產生相當大的公共利益與整體社會效益,但對這些藥廠面臨高額研發成本費用,市場需求不確定性與大製藥企業投資報酬率逐年下降(2017年的僅3.2%) (Deloitte, 2018),加上科技風險所可能造成的報酬損失及額外成本,以及公共研發補助的不穩定性,皆影響大藥廠投入疫苗開發之意願。
五、全球協調合作加速優先研究與創新
當涉及到傳染病(如新冠病毒、登革熱)時,開發疫苗或治療的社會效益,包含防止病毒傳播、治療疾病、挽救生命、降低社會大眾的恐慌與預防下一波流行。若能加快速控制疫情,也能降低對經濟造成的衝擊,這次新冠病毒衝擊中國經濟連帶全球各國也受衝擊,因中國是全世界汽車產業、手機製造供應鏈的一環,例如,汽車產業斷料衝擊造成全球汽車製造成長的風險(Ewing, 2020)。
疫苗開發有其必要性與急迫性,但疫苗開發所花費人力財力相當龐大還要跟病毒競賽,因為病毒在傳染期間也會演變,如原本動物傳人變成人傳人等,而製造疫苗的第一步需要確定疫苗包含病毒(或細菌)的蛋白質,若資料沒有分享或沒有平台給全球其他有技術單位則難以協助開發,需要各國的資訊、樣本、臨床數據共享。因應這次緊急公衛事件世界衛生組織在「策略防備與因應規劃」報告書,提出以下三點加速全球協調合作加強共同應變緊急事件(WHO, 2020a):
- 加強所有利害關係人的全球協調:需要一套緊急機制來協調全球進行研究與開發的不同利害關係人,而這套機制已經存在稱為全球協調機制(Global Coordination Mechanism),主旨在促進資料共享和資助者、產品開發者與研究者分享有關候選疫苗、治療和診斷方法的證據導入抵禦新冠病毒。協調填補研究與開發的缺口與避免重複工作。
- 確立清楚透明全球研究與創新的優先事項流程:全球研究路線圖須達成共識,這將使潛在的資助者和研究者能夠獲取關鍵資訊,促使他們能夠優先考慮COVID-19的投入和研究選擇。
- 建置標準化流程、協議和工具以及共享樣本、數據和資訊的通用平台:需要對生物採樣、樣本存儲、運輸、測試、記錄獲取和數據輸入的標準化達成一致共識,以確保研究分析數據的正確性與方法的可靠性。並且共享生物樣本、遺傳序列與臨床數據等加速疫苗(或其他治療方式)開發。
世界衛生組織在日內瓦(2/11~2/12)召開全球研究和創新論壇協調全球合作,預計制定新冠病毒研究議程確定優先次序與架構,以引導哪些計畫優先進行(WHO, 2020b)。
六、結語
本文透過簡介疫苗技術原理、多元開發途徑,以及不同開發途徑之特性,並評估CEPI之公共研發補助投資組合,說明CEPI主要聚焦於低度投資的技術平台、前臨床階段研究與臨床一期開發,且聚焦於開發時程較短的開發途徑。CEPI的研發投資組合對於大型企業所可能因管制政策介入及是否成為反覆出現流行病之不確定性,而面臨的需求及獲利不確定性,以及疫苗產生非預期副作用的科技風險,皆會使大企業不願投入攸關公共利益之疫苗開發。CEPI除了補助平台技術開發及製造開發之外,也應該補助品質研究,透過品質研究對於疫苗的科技風險進行更佳控制,以提升大企業投入疫苗開發之意願與開發進程。(6120字;圖2)
本文轉載自:META Evaluation 科技計畫評估社群支援平臺。
參考文獻
1. 吳培安(2020, February 19)賽諾菲攜手美HHS旗下BARDA開發COVID-19疫苗。環球生技雜誌。民109年2月25日,取自https://www.gbimonthly.com/2020/02/62566/
2. 吳培安(2019, December 23) FDA核准首款伊波拉病毒疫苗。環球生技雜誌。民109年2月14日,取自https://www.gbimonthly.com/2019/12/59679/
3. 科學人雜誌(2019) 致命的登革熱疫苗。科學人2019 年第209 期07 月號。民109年2月14日,取自https://sa.ylib.com/MagArticle.aspx?Unit=featurearticles&id=4414
4. Branswell, H. (2017, December 8) As foreign powers approve Ebola vaccines, U.S. drug makers lag in development pipeline. Retrieved February 25, 2020, from https://www.statnews.com/2017/12/08/ebola-vaccine-development/
5. Branswell, H. (2018, January 11) Who will answer the call in the next outbreak? Drug makers feel burned by string of vaccine pleas. Retrieved February 14, 2020, from https://www.statnews.com/2018/01/11/vaccines-drug-makers/
6. Branswell, H. (2020, February 6) In effort to develop coronavirus vaccine, outbreak expert sees ‘hardest problem’ of his career. Retrieved February 14, 2020, from https://www.statnews.com/2020/02/06/cepi-coronavirus-vaccine-development/
7. Burke E. (2017, October 19) DNA Vaccines explained. Retrieved February 20, 2020, from https://weekly.biotechprimer.com/dna-vaccines-explained/
8. Deloitte (2018). A new future for R&D? Measuring the return for pharmaceutical innovation 2017. Deloitte LLP. Retrieved February 20, 2020, from https://www2.deloitte.com/content/dam/Deloitte/uk/Documents/life-sciences-health-care/deloitte-uk-measuring-roi-pharma.pdf
9. Ewing, J. (2020, February 7) Chinese Car Factories Idled by Virus Raise Risks to Global Growth. Retrieved February 19, 2020, from https://www.nytimes.com/2020/02/07/business/coronavirus-china-auto-factories.html
10. Global Biodefense (2020, January 31). CureVac and CEPI Extend Their Cooperation to Develop a Vaccine Against COVID-19 . Retrieved February 19, 2020, from https://globalbiodefense.com/newswire/curevac-and-cepi-extend-their-cooperation-to-develop-a-vaccine-against-covid-19/
11. Inovio Pharmaceuticals Inc. (2020, January 23). Inovio Selected by CEPI to Develop Vaccine Against New Coronavirus. Retrieved February 15, 2020, from http://ir.inovio.com/news-and-media/news/press-release-details/2020/Inovio-Selected-by-CEPI-to-Develop-Vaccine-Against-New-Coronavirus/default.aspx
12. Moderna (2020, January 23). Moderna Announces Funding Award from CEPI to Accelerate Development of Messenger RNA (mRNA) Vaccine Against Novel Coronavirus. Retrieved February 20, 2020, from https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-funding-award-cepi-accelerate-development
13. Pagliarulo N. (2020, February 18). Sanofi starts work on coronavirus vaccine, bringing scale to global research effort. Retrieved February 25, 2020, from https://www.biopharmadive.com/news/sanofi-coronavirus-vaccine-barda/572449/
14. Rachlin E. & Watson M. (2017). mRNA Vaccines: Disruptive Innovation in Vaccination. May 2017. WHITE PAPER. Corporate Headquarters | 320 Bent Street | Cambridge, MA 02141.
15. Silveira MM, Oliveira TL, Schuch RA, McBride AJA, Dellagostin OA, Hartwig DD. (2017). DNA vaccines against leptospirosis: A literature review. Vaccine; 35(42):5559-5567. doi: 10.1016/j.vaccine.2017.08.067.
16. Tassey, Gregory (2005). Underinvestment in Public R&D. In A. N. Link & F. M. Scherer (eds.). Evaluating Public Sector R&D Programs: The Advanced Technology Programs Investment in Wavelength References for Optical Fiber(pp.87-97). Boston, MA: Springer US.
17. UQ News (2020, January 24). Race to develop coronavirus vaccine. Retrieved February 20, 2020, from https://www.uq.edu.au/news/article/2020/01/race-develop-coronavirus-vaccine
18. WHO (2020a). 2019 Novel Coronavirus (2019‑nCoV): Strategic Preparedness and Response Plan (Draft as of 3 February 2020). World Health Organization.
19. WHO (2020b).WHO to accelerate research and innovation for new coronavirus. Retrieved February 19, 2020, from https://www.who.int/news-room/detail/06-02-2020-who-to-accelerate-research-and-innovation-for-new-coronavirus
20. Zhang C, Maruggi G, Shan H, and Li J. (2019). Advances in mRNA Vaccines for Infectious Diseases. Front Immunol. 10: 594. doi: 10.3389/fimmu.2019.00594
--------------------------------------------------------------------------------------------------------------------------------------------
【聲明】
1.科技產業資訊室刊載此文不代表同意其說法或描述,僅為提供更多訊息,也不構成任何投資建議。
2.著作權所有,非經本網站書面授權同意不得將本文以任何形式修改、複製、儲存、傳播或轉載,本中心保留一切法律追訴權利。
|