|
一個新藥的誕生,由實驗室發掘新成分、評估作用機轉、量化生產、劑型設計、動物毒理試驗、臨床試驗到上市應用於治療,研發時程長達10~15年,所耗資金達150~200億台幣。[註]
|
|
新藥開發之定義
根據行政院衛生署藥事法第7條所稱新藥的定義,是指經中央衛生主管機關審查認定屬於新成分、新療效複方或新使用途徑製劑之藥品。生技新藥產業定義是指使用於人類及動植物用之新藥及高風險醫療器材之產業。
鄧哲明教授指出目前國內外新藥開發共有三大階段:
一、藥物探索,此階段包括新藥的發掘及其價值確效。現代醫療用藥物的重要來源包括:小分子化合物、蛋白質藥物、植物藥(含中草藥)等,新藥研發所需耗費成本約達5億美元,從先期研發到藥物通過上市許可,所需時間達10-15年之久,為能縮短新藥開發所需時程,整合多樣生命科學相關資訊,包括生物資訊學,蛋白質體工程,生物晶片等相關微陣列技術,即所謂先導藥物研發產業。藥效篩選與作用機轉探討,藥物的生物活性評估是一件非常複雜的工程,因不同目的而採用離體到活體試驗如酵素、受體、G-蛋白、細胞、組織、器官、活體動物到各種疾病動物模式。一個有藥效之化合物即(先導藥物,lead compound)通常需再合成千百個衍生物,評估並比較其活性、毒性、安定性、藥物動力學後,選上數個具有潛力者(候選藥物,candidate)進入下一階段之臨床前試驗。為了加快藥物研發的時程,藥廠或研究機構會有不同的策略,如以組合化學(combinatorial chemistry)來加快合成藥物的數量,並配合高效率篩選機器(high throughput screening)來評選出有效之化合物。有時需借助電腦,了解藥物與生物體結構之相互反應,來設計更具選擇性之衍生物,以提高藥效,降低副作用,並減少實際合成化合物之數量與成本。專利申請:新藥研發既然花費相當大,為了保障這些研發的智慧與技術,都會申請專利。藥物的專利申請,包括新物質、新製程及新適應症等,藥廠都有不同的策略與申請時程,以便對新藥的智財權作最大的保護,減少他廠仿冒機會。
二、臨床前試驗。須經過1. 化學、製造與監控CMC;2. 藥物動力學;3. 安全性藥理;4. 毒理實驗才可申請「試驗用新藥IND,通過審核後再執行臨床試驗。
三、臨床試驗(Clinical trials)。新藥的臨床試驗通常分成一至四期,其中一至三期是上市前申請「新藥查驗登記」NDA所需。臨床一期(Phase I)以健康之志願者為測試對象,通常20~50人,主要是觀察藥物對人體之安全性與藥理作用;臨床二期(Phase II)以小規模病人,通常50~300人,評估不同劑量對病人之有效性與安全性,以作為第三期臨床試驗劑量之依據;臨床三期(Phase III)擴大第二期之臨床試驗規模,以250~1000病人為試驗對象,依隨機分配法,將病人分類成試驗組和對照組;臨床四期(Phase IV)又名為上市後臨床試驗監視期,主要目的是新藥上市後,大規模病人群使用下,監視通報發現發生率極低之不良反應或嚴重副作用SAE甚或死亡之情形;有些嚴重明確之副作用,將導致政府當局下令停止生產,並下架回收。
今年4月17日召開的ITIS計畫春季研討會中介紹,掌握藥物劑型與傳輸系統的開發契機中,說明目前國內市場新藥研發焦點在於:持續/控制釋放系統為口服藥物傳輸技術的主流;注射/植入藥物則朝向長效型劑型技術發展,以減少用藥頻率;透過改良配方技術或與傳輸裝置新技術結合,改善植入/注射藥物的用藥不適及不便。尤其在2025年時,日韓皆預測新藥開發的未來方向仍有藥物傳輸技術、藥物標靶技術。
新藥開發技術之日韓未來前瞻趨勢
根據日本在2010年召開第九次前瞻之德菲議題與韓國在2011年底發佈第四次前瞻之德菲議題,皆預測新藥開發未來方向都區分為新藥開發/轉譯、人體試驗/安全評估、藥物傳輸技術、藥物標靶技術的相關範疇。

圖三.日韓新藥開發技術前瞻趨勢比較
| 新藥開發技術 |
機制說明 |
日本第九次前瞻之德菲議題 |
韓國第四次前瞻之德菲議題 |
| 新藥開發/轉譯 |
新藥設計合成篩選 |
1.可模擬藥物於體內動力學及作用之電腦模擬in silico醫藥開發技術(2019年技術實現) |
1.能查明ligand配位體的超精密,高選擇性電腦模擬in silico新藥開發技術 (2019年技術實現)2.運用適合的生物體支架,來調整新一代藥物的上市速度(2020年技術實現)3. 能讓人體的適應性達到最大化,用來生產生物藥品的智慧型細胞株之開發與培養(2021年技術實現)4.運用資訊學與機器人技術來研發新藥候選物質合成的前週期自動化系統(2022年技術實現)5.按照個人別,研發在檢測出疾病的同時,也能調配出藥物的組合型製藥機器(2024年技術實現) |
| 藥效評估/確認個人化醫療 |
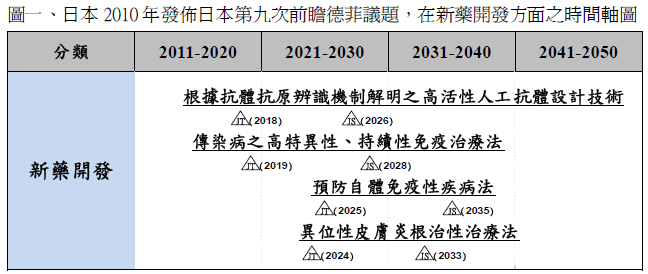
2. 可透過模擬模型之藥效評估臨床試驗(晶片臨床試驗) (2018年技術實現)3. 根據抗體抗原辨識機制解明之高活性人工抗體設計技術(2018年技術實現) |
6. 有關中藥的效能,查明其科學性的原理,並且在科學根據為基礎下來服用(2020年技術實現)7. 運用對人體有害性達99%以上,被清除的載體(vector)來研發基因治療劑(2022年技術實現) |
| 疾病治療 |
4.開發抑制癌症轉移之藥劑(2023年技術實現)5. 異位性皮膚炎根治性治療法(2024年技術實現) |
8. 能對抗癌細胞及轉移血管細胞的雙重目標抗癌劑(2022年技術實現) |
| 預防醫學 |
6 .傳染病之高特異性、持續性免疫治療法(2019年技術實現)7. 有效之癌症預防性化學藥物(2024年技術實現)8. 預防自體免疫性疾病法(2025年技術實現) |
|
| 人體試驗/安全評估 |
抗藥性檢測 |
1.癌症抗藥性檢測法(2018年技術實現)2.不同藥物間在細胞內外相互作用之鑑定技術(2019年技術實現) |
1.查明造成抗生素出現抗菌突變原因及基因移轉原因,並加以抑制之技術(2021年技術實現) |
| 幹細胞移植 |
3.異體造血幹細胞移植後之抑制免疫反應技術(2020年技術實現)4.運動功能麻痺透過神經幹細胞移植痊癒之評估及治療法(2023年技術實現) |
|
| 藥物傳輸技術 |
藥物傳導 |
1.磁導性藥物釋放系統(DDS) (2018年技術實現) |
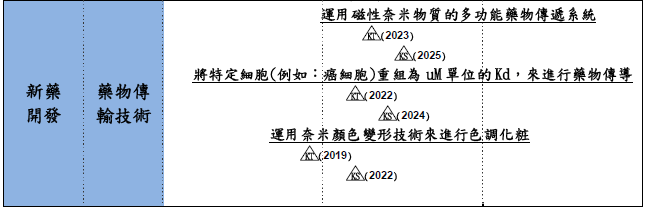
1.運用奈米顏色變形技術來進行色調化粧(2019年技術實現)2.將特定細胞(例如:癌細胞)重組為uM單位的Kd,來進行藥物傳導(2022年技術實現) |
| 奈米傳輸 |
2.利用外部能源控制、介觀級控制(Meso-control)或是微機電(MEMS)技術,將藥物或基因運送至標的物細胞內特定部位之奈米傳輸系統(2019年技術實現) |
3.運用磁性奈米物質的多功能藥物傳遞系統(2023年技術實現) |
| 藥物標靶技術 |
|
藥物標靶技術 |
藥物標靶技術 |
日韓新藥開發技術前瞻趨勢異同分析:
日韓新藥開發技術方面,日韓焦點都在開發蛋白質藥物,或用電腦模擬(in silico)的藥物開發方式,以及模擬模型之藥效評估臨床試驗(晶片臨床試驗)來降低成本
韓國主要投注於新藥設計合成與篩選。日本則著重於預防自體免疫性疾病、開發癌症預防性化學藥物及抑制癌症轉移之藥劑。韓國也是運用適合的生物體支架,調整新一代藥物的上市速度;對抗癌細胞及轉移血管細胞的雙重目標抗癌劑。但是韓國最大亮點在對於中藥的效能查明其科學性的原理,並且在科學根據為基礎下來服用;運用資訊學與機器人技術來研發新藥候選物質合成的前週期自動化系統;按照個人別,研發在檢測出疾病的同時,也能調配出藥物的組合型製藥機器。
日韓人體試驗/安全評估技術方面,日韓焦點都在抗藥性檢測,但日本著重於癌症用藥,韓國專注於抗生素;日本並對於不同藥物間在細胞內外相互作用之鑑定技術;且對於幹細胞移植有深入的研究貢獻,例如異體造血幹細胞移植後之抑制免疫反應技術,以及運動功能麻痺透過神經幹細胞移植痊癒之評估及治療。
日韓藥物傳輸技術技術方面,日本著重於磁導性藥物釋放系統(DDS);韓國也是運用磁性奈米物質的多功能藥物傳遞系統,且將特定細胞(例如:癌細胞)重組進行藥物傳導。日本且利用外部能源控制、Meso-control、微機電(MEMS)技術,將藥物或基因運送至標的物細胞內特定部位之奈米傳輸系統;韓國最大強項在於運用奈米顏色變形技術來進行色調化粧。
此外,日本、韓國都非常重視藥物標靶相關技術的推動。
[結語]
新藥研發的流程包括:藥物的探索與價值確效、產品開發之臨床前動物試驗、臨床試驗,具有臨床療效後,才能查驗登記並上市。由實驗室發掘新成分、評估作用機轉、量化生產、劑型設計、動物毒理試驗、臨床試驗到產品上市應用於治療,研發時程長達10~15年,所耗資金達150~200億台幣。新藥開發技術方面,目前國內新藥研發焦點在於:持續/控制釋放系統為口服藥物傳輸技術的主流;注射/植入藥物則朝向長效型劑型技術發展,以減少用藥頻率;透過改良配方技術或與傳輸裝置新技術結合,改善植入/注射藥物的用藥不適及不便。全球先進藥物傳輸載體的研發趨勢則因標靶抗體作用標的明確,可達更高藥效,目前標靶抗體占先進藥物傳輸載體巿場最大比例,並帶動微脂體及高分子的技術朝向結合標靶特性之載體,以達到標靶傳輸之目的。國際未來焦點為蛋白質藥物開發或用電腦模擬(In Silico)的藥物開發方式來降低成本。此外,日本、韓國亦重視藥物傳輸及標靶藥物相關技術的推動。在藥物的安全性評估上則受到各國重視。(3860字;圖2)
[參考文獻]
生技新藥產業發展條例 (2007)
鄧哲明 (2013)。新藥的研發流程概論。科學月刊。上網日期:2013年8月13日,取自
:http://scimonth.blogspot.tw/2013/03/blog-post_6173.html
鄧哲明 (2013)。何謂藥物開發。海峽生技醫藥品的風雲。上網日期:2013年8月13日,取自:http://alveice.blogspot.tw/2013/04/blog-post_6040.html
日本第九次前瞻之德菲議題 (2010)
韓國第四次前瞻之德菲議題 (2011)
賴瓊雅(2013)。掌握藥物劑型與傳輸系統的開發契機。ITIS智網。上網日期:2013年9月27日,取自:http://www2.itis.org.tw/PPTReport/PPTReport_Detail.aspx?rpno=2852