
以美國專利為基礎分析CRISPR技術發展狀況
科技產業資訊室 (iKnow) - 賴明豐 發表於 2018年1月12日
自發現DNA結構以來,透過許多科學家的研究成果發現許多遺傳疾病都源自於這些基因分子。尤其隨著生物醫學蓬勃發展,愈來愈多人開始期盼透過改變既有基因進而讓自己免於疾病的困擾或是最大化延長自己的壽命。但是,人類染色體中就包含三十億個鹼基,要想從這茫茫基因海中找出對應到特定功能的鹼基是相當困難的事情。
一、CRISPR是為何物?
早期用來進行基因或DNA編輯的工具有鋅手指核酸酶(Zinc-Finger Nucleases,ZFN)與類轉錄活化因子核酸酶(Transcription Activator-like Effector Nuclease,TALEN)兩種,這兩種都是用蛋白質來標定DNA位置,再透過FokI核酸酶剪斷基因繼而進行人工插入或移除的動作。不過,不論是ZFN或TALEN,在製備對應蛋白質上都非易事,且ZFN辨識專一性較差,TALEN則是分子過大不易導入。因此,這兩種編輯方法執行起來都相當困難。一直等到CRISPR技術出現之後才得以解決。
CRISPR最早是在大腸桿菌的iap基因中發現一段由repeat和spacer不斷重覆組成的DNA,所以才被最初發現它的科學家命名為CRISPR(clustered, regularly interspaced, short palindromic repeats)。2002年,科學家進一步發現CRISPR經常和cas基因連在一起,所以把這兩部份合稱為CRISPR/Cas。一直到2007年,才由法國生物化學家巴蘭古(R. Barrangou)解開CRISPR/Cas的秘密,原來它是細菌抵抗病毒攻擊的一套免疫系統。
當病毒攻擊細菌後,如果細菌沒死,就會把病毒遺留下來的DNA片段加到CRISPR內成為自己的一段spacer。所以如果一隻細菌曾被十個不同病毒輪番攻擊而不死,就會在自己的CRISPR中增加十個spacer。等到下次再被病毒攻擊時,細菌的CRISPR/Cas會用crRAN/tracrRNA比對病毒的DNA序列。如果發現是跟自己的某個spacer一模一樣,那Cas核酸酶就會把病毒的DNA剪斷,使其失去攻擊能力。其中,又以Cas9核酸酶的效率最好,最受科學家的青睞。
未來,不論是新藥開發或是疾病治療都可能牽涉到基因或DNA的編輯。因此,CRISPR/Cas9可以說是商機無限大,各方人馬都在積極搶食這塊大餅(三大專利平台及授權狀況如圖一示),其中就以杜德娜(Jennifer A. Doudna)與張鋒(Feng Zhang)團隊間的爭鬥最激烈。基本上,正式提出CRISPR/Cas9可程式化細菌免疫系統的是卡彭蒂耶(Emmanuelle Charpentier)與杜德娜,而張峰則是將這套系統應用於哺乳動物多基因編修目的上並獲得成功。
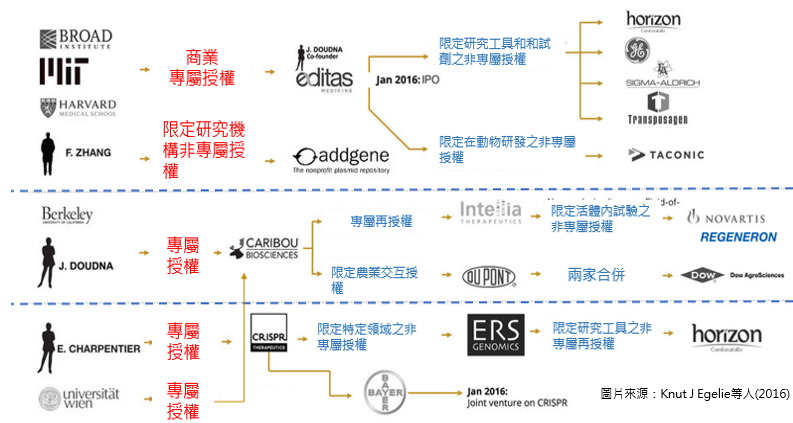
圖一、CRISPR–Cas9先期三大專利平台及授權狀況
二、CRISPR專利檢索與分析
本文目的在從專利角度瞭解CRISPR技術的發展狀況,透過Derwent Innovation以全文檢索方式檢索美國專利資料庫公開公告件與核准件,使用的關鍵字詞包括「clustered regularly interspaced short palindromic repeats」、「CRISPR-associated proteins」、「CRISPR/Cas」,以及「CRISPR/Cpf1」等,再進一步去除重覆專利與家族專利後,最後還有771筆專利。
從數據整理結果來看,近幾年,美國申請CRISPR相關技術專利數量的成長幅度驟增(如圖二),顯見市場中各方勢力佈局力道非常積極,每年投入佈局的專利權人人數都在迅速擧昇(如圖三)。其中,以玉米種業為主的杜邦先鋒公司(Pioneer Hi-Bred Inc)與專注在調節遺傳基因及編輯基因的生物醫藥品公司Sangamo Therapeutics申請件數最多,其次才是哈佛大學、加州大學,以及麻省理工學院。截至2017年7月24日為止(即以本研究檢索的專利資料來看),有99件申請案順利取得專利權,僅佔所有申請件數一成多。這些核准件平均都等了一年,但也有等了九年才拿到專利權的情形。
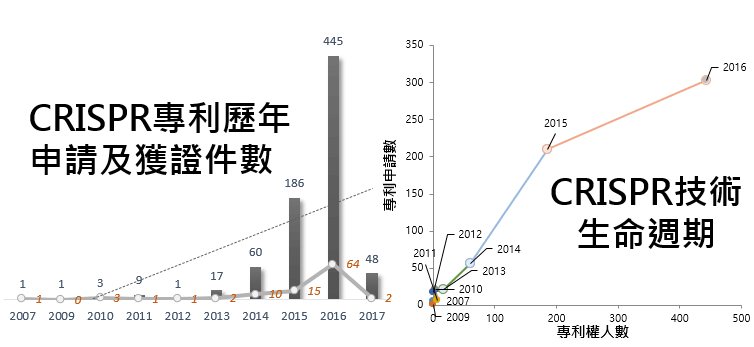
圖二、CRISPR專利歷年申請及獲證件數 圖三、CRISPR技術生命週期
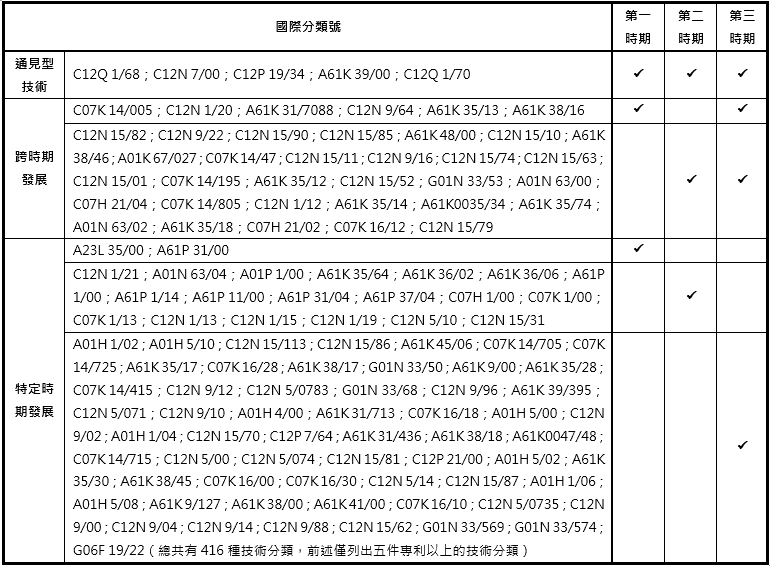
另外,CRISPR的研發項目範疇也不斷在擴大(如表一),本文根據圖二將CRISPR的技術發展概分為三個時期,第一時期由2007年到2010年,第二時期由2011年到2013年,第三時期則是2014年到2017年7月24日止。在第一時期CRISPR僅涉及13種技術分類,第二時期增加至54種,到了第三時期則已爆漲到457種,短短十年間技術發展範圍的擴張速度相當驚人。在通見型技術中,涉及C12Q 1/68(酶及核酸之測定、檢測或其組合物的製備方法)的專利件數最多(101件),其次是C12N 7/00(病毒其組合物或其製備或純化,32件)。在跨時期發展的技術中,則以C12N 15/82(用於植物細胞之載體或表達系統)、C12N 9/22(核糖核酸酶)與C12N 15/90(將外來DNA穩定地引入染色體內)等專利件數最多,這些項目都有超過百件專利佈局其中,其次才是C12N 15/85(用於動物細胞之載體或表達系統)。
表一 CRISPR歷年技術落點分析
進一步觀察超過六件專利以上技術分類間共同出現在任一篇專利的狀況(如圖四),可以知道CRISPR技術中大量使用到C12N 9/22、C12N 15/90與C12N 15/82等技術,並透過C12N 15/85、C07K 14/705(來自動物或人物的受體;細胞表面抗原;細胞表面決定子)、A61K 48/00(含有引入活體細胞以使治療基因疾病之基因物質的醫藥製品)向外橋接擴散到其他技術項目。另外,本文也透過Clauset-Newman-Moore分群方法計算後得到四組技術集群:
- 集群一:由A61K 38/17(衍自動物或人之肽類、胃泌激素、生長激素釋放抑制素或促黑激素等等)、A61K 48/00、A61K 9/00(以特殊物理形態為特徵之醫藥配製品)、A61K 38/46(水解酶)、C07K 14/47(衍自哺乳動物之肽類、胃泌激素、生長激素釋放抑制素或促黑激素等等)、C12N 15/90、C12N 9/22、C12P 19/34(多核苷酸,如核酸,寡核糖核苷酸)、C12N 9/96(用形成一種加合物或組合物之方法予以穩定酶;形成酶結合物)、C12N 7/00、C12N 15/86(用於動物細胞的病毒載體)、C12N 15/113(非編碼核酸調節基因的表達)、C12N 15/11(DNA或RNA片段其修飾形成)等項目組成,並參考度數指標將集群一命名為「突變或基因工程:涉及DNA/RNA、載体,或其分離、製備或純化」,重要發明人包括May, Andrew Paul、Zhang, Feng、Maeder, Morgan L.、Bumcrot, David A.、Donohoue, Paul Daniel與Doudna, Jennifer A.,相關被引用次數最高的專利有2015/0,044,772、2015/0,064,138、2014/0,017,214與2014/0,127,752。
- 集群二:由C12N 5/14(植物細胞融合)、C12N 15/82、A01H 5/10(種籽)、A01H 1/02(雜交之方法或設備;人工授粉)、A01H 1/04(改良基因型過程選擇之方法)、C12Q 1/68、A01H 4/00(利用組織培養技術之植物再生)、A01H 5/00(有花植物)、C07K 14/415等項目組成,並參考度數指標將集群二命名為「DNA重組技術:用於植物細胞的載體」。重要發明人包括Ross, Andrew Jon、Lira, Sara Jane、Barker, Thomas Charles、Wardyn, Brandon Michael與WEBB, Steven R.,相關被引用次數最高的專利有2013/0,326,645、2015/0,056,629與2011/0,300,538。
- 集群三:由A61K 39/395(抗體;免疫球蛋白;免疫血清)、C07K 14/725(T-細胞受體)、C07K 14/705、C12N 5/0783(T細胞;NK細胞;及其前驅細胞)、A61K 35/17(淋巴細胞;B-細胞;T-細胞;自然殺傷細胞;干擾素活化或細胞激素活化的淋巴細胞)、C07K 16/28(對抗受体、細胞表面抗原或細胞表面決定子的免疫球蛋白) 等項目組成,並參考度數指標將集群三命名為「來自動物(含人類)的肽類、胃泌激素、生長激素釋放抑制因子、促黑激素及其衍生物」。重要發明人包括June, Carl H.、Brogdon, Jennifer、Milone, Michael C.、Mannick, Joan、Murphy, Leon、Glass, David與Wu, Qilong,相關被引用次數最高的專利有2015/0,283,178、2016/0,068,601與9,393,396。
- 集群四:由C12N 15/10(經引入外來遺傳材料而修飾的細胞,如病毒轉化的細胞)、C12N 15/85(用於動物細胞之載體或表達系統)、A01K 67/027(飼養或養殖脊椎動物之新品種) 等項目組成,並參考度數指標將集群四命名為「DNA重組技術:用於動物細胞的載體」。重要發明人包括Valenzuela, David M.、Auerbach, Wojtek、Lai, Ka-Man Venus、Frendewey, David、Carlson, Daniel F.、Fahrenkrug, Scott C.與WEST, James,相關被引用次數最高的專利有2013/0,326,645、2015/0,252,358與2015/0,098,954。
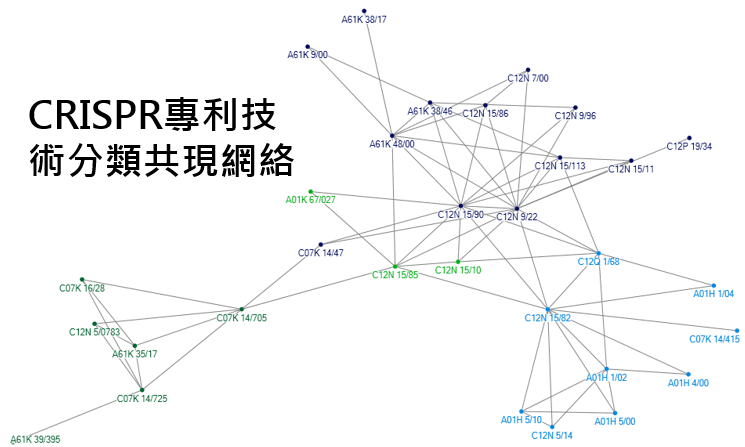
圖四、CRISPR專利技術分類共現網絡
三、小結
由前面專利數據整理分析的結果可以知道,目前美國市場相當熱衷CRISPR技術,有大量專利權人投入研發行列、專利申請數量不斷增加,研發範圍也擴散超過四百多種技術項目,大致上可以區分為四個研發重點。首先就是「突變或基因工程:涉及DNA/RNA、載体,或其分離、製備或純化」,杜德娜與張峰就屬於這塊技術的重要發明人。從圖二可以知道其他三種研發方向都是以這塊為基礎再經由一些扮演橋接角色的技術進一步擴散發展出去。其他還包括「來自動物(含人類)的肽類、胃泌激素、生長激素釋放抑制因子、促黑激素及其衍生物」、「DNA重組技術:用於植物細胞的載體」,以及「DNA重組技術:用於動物細胞的載體」等。國內有興趣CRISPR技術研發的專家學者可以參考本文整理出來的結果,針對特定專利權人蒐整相關技術專利,或是就不同集群瞭解重要發明人或高被引用專利在CRISPR技術上的研發狀況。
從醫療角度來看,CRISPR/Cas這套系統將會帶來重大的改變與影響,許多被認為是絕症的疾病都可能因此產生顛覆性的改變。除此之外,也有科學家把CRISPR/Cas運用到農業、食品及公共健康應用等領域。不過,目前CRISPR/Cas還有許多問題等待解決,例如脫靶問題可能會因為在預期之外的地方切割基因而導致無法預測的結果。因此,各國政府必須儘快就相關法令規範、政策、倫理,以及可能對生態造成的問題積極展開討論與對話,以便面對這項革命性的基因科技未來可能造成的影響與效應。(3600字;圖1)
參考資料:
- Alice Park(20178/21),美科學家首次運用CRISPR系統,在人類胚胎時期修復基因缺陷。時代雜誌。
- GENE ONLINE(2016/1/26),CRISPR:開啟基因治療的契機。網址:https://geneonline.news/index.php/2016/01/26/crispr/
- 中國食品機械設備網(2017/1/25),CRISPR基因編輯技術上線 將對食品工業影響重大。網址:https://read01.com/zh-tw/2B6OaP.html#.Wc4RiMZx2pc
- 生命科學論壇(2015/3/25),科學家呼籲限制使用CRISPR技術。網址:科學家呼籲限制使用CRISPR技術
- 林世青(2014/8/26),「DNA編輯大師」張鋒與CRISPR/Cas9基因編輯技術。科學ONLINE,網址:http://highscope.ch.ntu.edu.tw/wordpress/?p=55722
- 泛科學(2017/6/26),CRISPR/Cas9 基因編輯技術從何而來,又將帶我們走向何方?網址:http://pansci.asia/archives/121619
- 科學ONLINE(2010/11/1),細菌的防禦作用:限制酶(Restriction enzyme)和特殊的重複序列CRISPR-下。網址:http://highscope.ch.ntu.edu.tw/wordpress/?p=14150
- 科學網,CRISPR若問鼎諾獎,誰將是大贏家——原始文獻圖文詳解。網址:https://read01.com/gPxJk5.html#.Wc4K1sZx2pc
- 孫雷銘(2015/9/2),DNA編輯大師CRISPR/Cas9,開創新時代的基因編修技術。科技新報,網址:https://technews.tw/2015/09/02/about-dna-crisprcas/
- 馬千惠(2017/3/17),CRISPR 基因編輯動物園。CASE報科學,網址:http://case.ntu.edu.tw/blog/?p=27189
- 郭曉強(2016/1/28),CRISPR-Cas9技術發明簡史。網址:http://blog.sciencenet.cn/blog-2742581-952946.html
- 維基百科(2017/9/19),CRISPR。網址:https://zh.wikipedia.org/wiki/CRISPR
- Knut J. Egelie, Gregory D. Graff, Sabina P. Strand, and Berit Johansen(2016), The emerging patent landscape of CRISPR-Cas gene editing technology. Nature Biotechnology, 34, pp.1025-1031.
本站相關文章:
1.CRISPR加入MPEG LA專利池授權模式與專利佈局
2.MPEG LA之CRISPR-Cas9聯合授權推廣專案:麻省理工學院和哈佛大學布洛德研究所等機構加入
3.DNA/RNA檢測裝置,Life Technologies 公司提告Illumina公司
4. Life Technologies掀起生技檢測專利訴訟戰
5.美國最高法院判決Myriad基因專利是否具備專利標的適格性--Association for Molecular Pathology v. Myriad Genetics, Inc. 判決概述
--------------------------------------------------------------------------------------------------------------------------------------------
【聲明】
1.科技產業資訊室刊載此文不代表同意其說法或描述,僅為提供更多訊息,也不構成任何投資建議。
2.著作權所有,非經本網站書面授權同意不得將本文以任何形式修改、複製、儲存、傳播或轉載,本中心保留一切法律追訴權利。
|