2014年9月2日,營業處所設在美國賓夕法尼亞州、為Teva Pharmaceutical Industries Ltd之全資子公司的Cephalon, Inc.(下稱Cephalon),向美國達拉瓦州聯邦地院提起專利侵權告訴,控告我國上櫃之生技製藥公司南光化學製藥股份有限公司(Nang Kuang Pharmaceutical Co., LTD.,下稱南光),以及與南光簽訂研發生產抗癌藥品等銷售合約之CANDA NK-1, LLC(其為CANDA Pharma LLC位於美國德州的子公司,下稱CANDA),兩家公司合作向美國食品藥物管理局(FDA)所提出、以bendamustine(音譯為苯達莫司汀)為成分的抗癌藥注射劑學名藥上市許可申請(ANDA No. 206554,其申請標的為用於注射之鹽酸苯達莫司汀25 mg/vial與100mg/vial,bendamustine hydrochloride for injection, 25 mg/vial and 100 mg/vial),就本案4項系爭專利構成侵權。而後於9月3日,Cephalon又向美國紐約州南區聯邦地院提起另一起專利侵權告訴,起訴內容與前述案件相同。
Cephalon製造生產以bendamustine為成分之品牌藥TREANDA ®注射劑,用於治療慢性淋巴性白血病(chronic lymphocytic leukemia,CLL)與非何杰金式淋巴瘤(non-Hodgkin lymphoma,NHL)等癌症。TREANDA®注射劑目前在國內並未被核准上市,而國內目前核准上市、以bendamustine為成分之藥品為,因華生技製藥股份有限公司所申請的普癌汰乾粉靜脈注射劑(Innomustine Injection)。
本案四項系爭專利內容如下:
美國專利編號US 8,445,524,名稱為「固態之鹽酸苯達莫司汀(Solid forms of bendamustine hydrochloride)」,於2013年5月21日核發;
美國專利編號US 8,436,190 、US 8,609,863與US 8,791,270,名稱均為「苯達莫司汀藥用化合物(Bendamustine pharmaceutical compositions)」,分別於2013年5月7日、2013年12月17日與2014年7月29日核發。US 8,791,270專利與US 8,609,863專利均為US 8,436,190專利在申請時的連續案(continuation)。
南光成立於1963年,以專業生產針劑產品為主要核心技術,產品包括大型輸注液(PP軟袋) 、無菌注射劑(安瓿、管瓶)、凍乾注射劑、預充注射劑,以及錠劑(含膜衣錠)、膠囊、軟膏、顆粒等,為國內最大注射劑專業製造廠。南光資本額超過新台幣6.3億、年營收近新台幣8億,並已於2005年6月掛牌興櫃,並於2009年8月份股票正式上櫃。
根據上櫃公司公開資訊觀測站之資訊,南光於2014年8月13日與CANDA簽訂研發生產抗癌用藥等銷售合約,並聯手推動部分學名藥品在美國的銷售。南光在前述公開資訊中說明,其會借重CANDA在專利訴訟與學名藥品推動上市方面所擁有的豐富經驗,藉以提升南光在美國專利訴訟的攻防力道,並促成學名藥品順利取得美國藥品許可證;同時,南光與CANDA已著手籌劃一連串擴展德州據點的業務計畫與行銷策略,並將持續且廣泛地帶動人員訓練、銷售管道以及產品製造等各方面的合作發展。
Cephalon光是在2014年,便對不同製藥公司所提出bendamustine注射劑學名藥上市許可申請案,提起超過8件以上的專利侵權訴訟,而由此亦可看出,bendamustine注射劑學名藥的市場商機。(1480字;表3)
表一、請求項解析
| US 8,445,524請求項1 |
US 8,436,190請求項1 |
| 1. A solid form of bendamustine hydrochloride, designated as bendamustine hydrochloride Form 1, that produces an X-ray powder diffraction pattern comprising the following reflections: 8.3, 16.8, and 18.5±0.2 degrees 2θ.一項固態之鹽酸苯達莫司汀,其被指定為鹽酸苯達莫司汀第1型,其具有8.3、16.8以及18.5±0.2 之2θ值的X光粉末繞射圖。 |
1. A pharmaceutical composition comprising bendamustine or bendamustine hydrochloride, mannitol, tertiary-butyl alcohol and water.一項藥用化合物,其包含苯達莫司汀或鹽酸苯達莫司汀、甘露醇、三級丁醇以及水 |
FIG. 2 is an X-ray Powder Diffractogram (XRPD) of bendamustine hydrochloride Form 1FIG.2為鹽酸苯達莫司汀第1型之X光粉末繞射圖(XRPD)
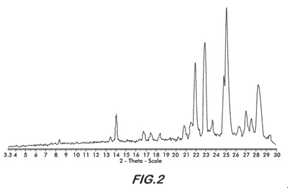 |
FIG. 1 shows the solubility of bendamustine at various temperatures for two different solutions of bendamustine in tertiary butanol.FIG.1顯示在不同溫度下,溶解苯達莫司汀於三級丁醇中之不同溶液的溶解度
 |
| US 8,609,863請求項1 |
US 8,791,270請求項1 |
| 1. A stable lyophilized preparation comprising bendamustine hydrochloride, mannitol, and a trace amount of tertiary-butyl alcohol (TBA), wherein the ratio by weight of bendamustine hydrochloride to mannitol is 15:25.5.一項穩定之冷凍乾燥製劑,包含鹽酸苯達莫司汀、甘露醇與微量之三級丁醇,其中鹽酸苯達莫司汀與甘露醇之比重為15:25.5 |
1. A pharmaceutical composition that has been reconstituted from a lyophilized preparation of bendamustine or bendamustine hydrochloride, said composition containing not more than about 0.9% (area percent of bendamustine) of HP1:一項藥用化合物,其從苯達莫司汀或鹽酸苯達莫司汀之冷凍乾燥製劑還原出來,前述化合物包含不多於0.9%之HP1
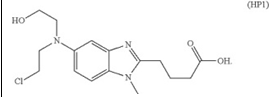 |
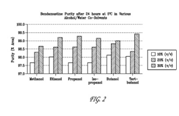
FIG. 2 shows the purity results of an HPLC analysis after incubating bendamustine in various alcohols for 24 hours at 5° C.FIG.2顯示在5° C溫度於不同酒精溶液中生成bendamustine,在24小時後經高效液相層析法(HPLC)之純度結果。
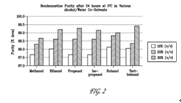 |
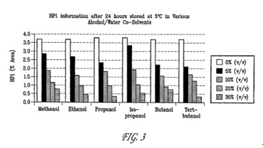
FIG. 3 shows HP1 (Formula II) formation after 24 hours in various alcohol/water co-solvents at 5° C.FIG.3顯示在5° C之不同酒精/水的共溶劑中經過24小時後HP1之形成情形
 |
Source: 科技政策研究與資訊中心—科技產業資訊室整理,2014/09
表二、專利訴訟案件基本資料Cephalon控告南光與CANDA
| 訴訟名稱 |
Cephalon, Inc. v. Nang Kuang Pharmaceutical Co. LTD et al |
Cephalon, Inc. v. Nang Kuang Pharmaceutical Co. LTD et al |
| 提告日期 |
2014年9月2日 |
2014年9月3日 |
| 原告 |
Cephalon, Inc. |
Cephalon, Inc. |
| 被告 |
Nang Kuang Pharmaceutical Co., LTDCANDA NK-1, LLC |
Nang Kuang Pharmaceutical Co., LTDCANDA NK-1, LLC |
| 案號 |
1:14-cv-01117 |
1:14-cv-05180 |
| 訴訟法院 |
the U.S. District Court for the District of Delaware |
the U.S. District Court for the Eastern District of New York |
| 系爭專利 |
US 8,445,524
US 8,436,190
US 8,609,863
US 8,791,270 |
US 8,445,524
US 8,436,190
US 8,609,863
US 8,791,270 |
| 系爭產品 |
南光與CANDA的bendamustine注射劑學名藥尚未被核准上市,而Cephalon所生產的品牌藥TREANDA R注射劑,其相關資訊可見:http://www.treanda.com/cll/default.aspx (最後瀏覽日:2014/09/08) |
南光與CANDA的bendamustine注射劑學名藥尚未被核准上市,而Cephalon所生產的品牌藥TREANDA R注射劑,其相關資訊可見:http://www.treanda.com/cll/default.aspx (最後瀏覽日:2014/09/08) |
| 訴狀下載 |
 |
 |
Source: 科技政策研究與資訊中心—科技產業資訊室整理,2014/09
表三、Cephalon在2014年所起訴之其他bendamustine學名藥相關訴訟
| 日期 |
案件名稱 |
被告 |
案號 |
訴訟法院 |
系爭專利 |
| 2014年1月31日 |
Cephalon Inc. v. Actavis LLC et al |
Actavis LLCActavis Elizabeth LLC |
1:14-cv-00122 |
the U.S. District Court for the District of Delaware |
US 8,445,524US 8,436,190 |
| 2014年3月14日 |
Cephalon Inc. v. Sun Pharma Global FZE et al |
Sun Pharma Global FZESun Pharmaceutical Industries Ltd.Sun Pharmaceutical Industries Inc. |
1:14-cv-00333 |
US 8,609,863 |
| 2014年3月14日 |
Cephalon Inc. v. Dr. Reddy's Laboratories Ltd. et al |
Dr. Reddy's Laboratories Ltd.Dr. Reddy's Laboratories Inc. |
1:14-cv-00334 |
US 8,609,863 |
| 2014年3月17日 |
Cephalon, Inc. v. Emcure Pharmaceuticals Ltd. et al |
Emcure Pharmaceuticals Ltd.Emcure Pharmaceuticals USA Inc. |
3:14-cv-01705-PGS-DEA |
the U.S. District Court for the District of New Jersey |
US 8,445,524 |
| 2014年4月30日 |
Cephalon Inc. v. Uman Pharma Inc. |
Uman Pharma Inc. |
1:14-cv-00568 |
the U.S. District Court for the District of Delaware |
US 8,445,524US 8,436,190 |
| 2014年5月1日 |
Cephalon, Inc. v. Uman Pharma Inc. |
Uman Pharma Inc. |
1:14-cv-03114-TPG |
the U.S. District Court for the Eastern District of New York |
US 8,445,524US 8,436,190 |
Source: 科技政策研究與資訊中心—科技產業資訊室整理,2014/09
--------------------------------------------------------------------------------------------------------------------------------------------